1.低温透射电镜技术概述
低温透射电镜技术是在低温下(通常在 90K)将液相样品中的水或其它溶剂快速冷冻固定后,在低温环境下使用透射电镜进行观察的技术。低温透射电镜实验要求样品在制样、传输和观察整个过程中都保持在低温状态(通常低于100 K),相对于常温透射电镜,其优势有:1)快速冷冻制样技术将样品固定在玻璃态的冰层中,避免了水或溶剂结晶对样品结构的破坏,能够保持液相中有机分子自组装体和化学反应中间体的微观结构,避免了样品干燥引起的结构变化;2)高分子及化学反应体系常常具有非平衡态结构,快速冷冻制样技术能够保持住非平衡态结构,进而得以观察;3)低温条件能够尽可能保持有机和高分子等软物质材料的微观结构,显著减少电子束对样品的损伤。
2.系统组成及操作流程
分析测试中心电镜组利用现有仪器(Leica EM GP 全自动载网投入冷冻仪、Gatan 626 单倾冷冻传输样品杆、Jem-2011 透射电镜等),开展了低温透射电镜工作。具体操作流程如下:

2.1 冷冻制样
冷冻制样的关键是要在载网上得到厚度合适的玻璃态的冰层。冷冻环境下, 样品中溶剂(水)的粘性会显著提高,在极高的粘性下,所有样品组分包括水都被完全固定,不能移动。但是,当水分子结晶形成冰晶,就会破坏样品的结构, 因此,要阻止冰晶形成,使得水成为玻璃态(vitrified), 或者称之为非结晶态冰(无定形冰)。
水结晶的条件包括:(1)温度必须低于熔点(常压下水容易形成过冷水, 从 231 K 开始结晶);(2)具有晶核;(3)有足够的能量,高于重结晶温度(常压下,纯水的重结晶温度约为 136K, 低于这一温度,水分子没有足够的能量进行分子重排,从而无法结晶);(4)有足够的时间分子重排。纯水在 231 K~136K 的温度范围内经过一定的时间可以结晶形成冰晶,所以要得到玻璃态的冰,就需要降温时迅速通过这一温度范围,即要求快的冷冻速率和尽可能窄的结晶温度范围。
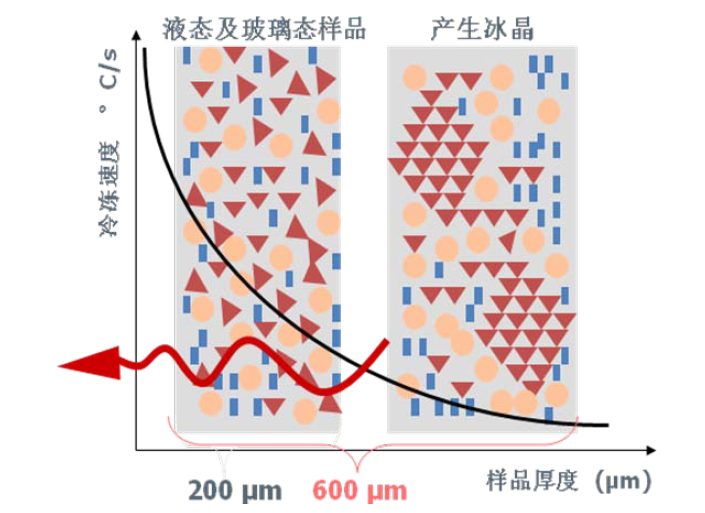
冻冷速率随样品厚度的变化图
对于一定的样品而言,水的热扩散率和样品厚度决定了样品的冷冻速率[1,2]。在常压情况下,只有当冷冻速率大于 5 105 K/s,才有足够的时间提取热量防止冰晶产生。同时,水的热扩散率很差,对于较长距离,热量无法有效释放(图 1)。例如,对于 600µm 厚的含水样品,即使其表面冷冻速率达到理论临界冷冻速率(> 5 105 K/s),在距离样品表面 150µm 处,冷冻速率也会降到低于 1000 K/s。因此,在常压下,很难形成较厚的玻璃态的冰层。20 世纪 70 年代,Moor 引入了高压冷冻固定法[3,4,5,6]。增加压力到一定程度可显著降低水分子的成核温度, 缩短水的结晶温度区间(图 2),从而增加了冷冻固定样品的厚度。
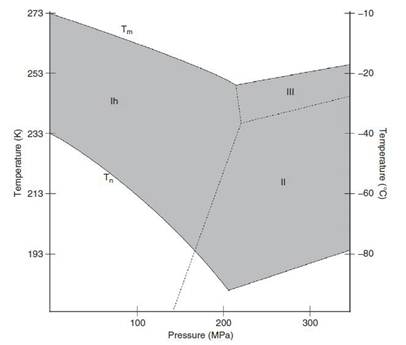
水的相图
在常压下,100nm 厚水膜可以被有效玻璃化冷冻[8],满足此条件的样品可以选择投入式快速冷冻制样法。高压条件下,可以有效固定 200 mm 以下的厚水膜,适合此条件的样品可以选择高压冷冻技术制样法。
2.1.1 投入式快速冷冻制样
投入式快速冷冻制样是液相样品进行冷冻固定的基本方法,是将样品快速插入到液态乙烷中(90K,以液氮冷冻),使样品中的水/其他溶剂快速冷冻(冷冻速度可达 10,000K/s)固定于电镜载网上,此过程中水和其它溶剂不结晶成为玻璃态(vitrified),能够限度的保持样品的结构。这种制样方法要求样品大小、厚度、粘度等不能太大,否则可能会出现样品脱落,电子束无法穿透样品,不能通过自动吸附过程得到厚度合适的样品薄膜等情况。
在投入式快速冷冻技术中,采用将载网以自由落体的形式快速投入到冷冻剂中的方式,是因为成功的冷冻固定取决于冷冻过程是否能够迅速通过水结晶的温度范围,要求冷冻速度太快以至于水来不及结晶。冷冻剂选择的是在液氮“水浴” 环境中的液化乙烷。乙烷的比热比氮气的比热更大,冷冻速度更快;乙烷的沸点比氮气高,在液氮“水浴”环境中可以液化,得到一个更加稳定且快速的冷冻环境。
具体操作步骤为:将载网(一般选用 GiG-C321 型号的微筛阵列碳支持膜) 置于一个温度/湿度可控的环境仓中,温度可在 279K- 335K 之间调节,湿度可在大气湿度到 99%调节(图 3a, 3b)。在电镜载网上滴加样品悬液后(通常3μL,图 3a),通过滤纸自动吸附过程吸走一些样品留下适量样品形成电子束能够穿透的薄膜,然后载网被快速投入液态乙烷中进行冷冻(图 3c)。在投入冷冻完成后,将载网快速转移到样品盒并保存在液氮中,用于后续观察。
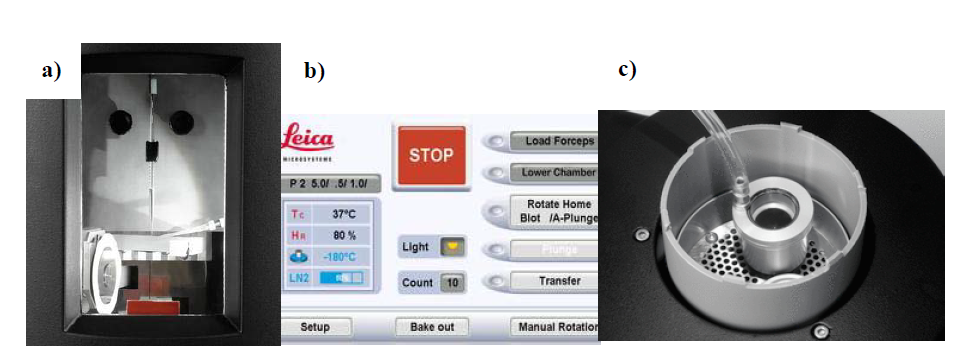
a)在可控的样品环境仓内向载网上滴加样品 b) 可编程的参数设定 c)液化乙烷的头部液化装置
2.1.2 高压冷冻制样
在常压下,技术改进并不能帮助玻璃化冷冻更厚的样品。而高压条件下,降低了水的结晶温度范围和临界降温速率,使得到的有效玻璃化厚度更大。因此要制备尺寸较大、粘度较高的样品,需要通过加压来实现。
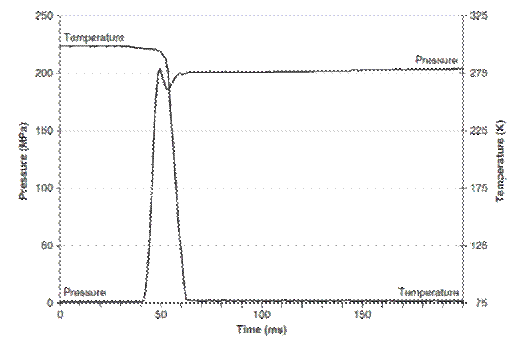
Leica EM HPM100 型高压冷冻仪冷冻曲
从 Leica EM HPM100 型高压冷冻仪冷冻曲线图[11]中,我们可以看出,在 10ms 内,压力升高至 200MPa,一旦达到所需压力值,温度开始下降(从 310K 开始),当温度降至晶核形成温度(181K)直到温度低于约 136K,这一温度区间内,冰晶可以形成。对于 200 mm 厚的样品,样品中心区域通过这一温度区间大约需要 30ms,压力平均值 204.5MPa。
高压冷冻方法是目前唯一能够将玻璃化的厚达 200 mm 的冷冻固定方法。由于高压冷冻的样品较厚,无法直接进行透射电镜观察,因此在冷冻固定后,需要使用冷冻超薄切片机在冷冻状态下超薄切片,制得适合透射电镜观察的样品方可进行冷冻透射电镜观察。高压冷冻固定技术由于样品冷冻固定的时间必须要足够快(小于 50 毫秒),所以局限是对样品的大小有限制(直径:1-2mm,厚度:200 mm).
2.2 冷冻传输
将制得的冷冻透射样品,在液氮中转移至低温样品装载装置,置于冷冻样品杆上,样品固定好之后,快速的将样品杆拔出转移到透射电镜中。在样品转移和观察中保持在低温环境(通常低于 100K)。
冷冻传输系统保证了样品从装入样品杆到进入电镜的整个过程中都处于一个低温并且相对洁净的环境中,避免样品在转移过程中因为温度的改变被破坏或者因为暴露在大气中被污染。
2.3 低温透射电镜样品的测试
目前,分析测试中心电镜组是利用冷冻传输样品杆在透射电镜 Jem-2011 上实现低温透射电镜样品的测试,可以满足一部分样品的测试需求,但是由于这台电镜为普通透射电镜,所以样品的漂移稳定性较差,而且无法使用低剂量技术致使很多样品的冰层容易破坏,所配置相机成像的衬度也有限,很多低衬度样品无法进行观察。为了获得高分辨率、高衬度的结果,分析测试中心今年将引进一台专门的低温透射电镜(Cryo-TEM),与普通透射电镜相比,专业的低温透射电镜的极靴是冷冻型极靴,即在极靴部分增加了一个冷冻盒(图 5)。冷冻盒可以保持样品周围的低温环境,既减少了样品上冰(晶) 沉积引起的污染,也大大减少了样品的漂移,同时配备高性能相机,显著提高成像的衬度和速度。
具体地,低温透射电镜的特点包括:(1)分辨率更高,可以得到更好的高分辨成像;(2)可以使用较低的电子束,精确控制电子剂量使冰层不被打坏;(3)漂移稳定性好,可以长时间的有效采集数据并进行三维重建;(4)可选择过滤特定的能量,去除杂散/背底信号,提高衬度,提高信噪比;(5)可通过增加相位板、高性能相机等配件进一步提高样品衬度及空间分辨率。
低温透射电镜的冷冻极靴示意图
3.低温透射电镜应用实例
胶束体系对于浓度、pH、添加剂种类等液相环境条件的变化非常敏感,如果是干燥状态其结构与有液相完全不同,因此必须用低温透射电镜表征其结构。通常情况下,胶束有球状、囊泡状、棒状、层状、六角束状、洋葱状、蠕虫状等多种形状,图 6 是分析测试中心电镜组用现有的低温透射电镜系统观察得到的囊泡及球状、棒状、短线状胶束的透射电镜图,可以看出应用冷冻透射电镜技术, 囊泡、胶束的结构被原位的真实呈现出来,可清晰地观察到囊泡的完整性、分布、大小、融合等情况,而在普通电镜条件下,干燥后的囊泡的形状、结构很容易发生变化。

应用分析测试中现有的低温透射电镜系统得到的透射电镜图 a)囊泡 b)融合囊泡c)球状、棒状胶束 d)线状胶束

应用分析测试中现有的低温透射电镜系统得到的的透射电镜图 a)带状聚合物 b)线状聚合物
同样,低温透射电镜也能够有效保持聚合物在液相的形态,如上图是应用我们现有的低温透射电镜系统得到的带状、线状聚合物的电镜图,可清晰地观察到聚合物的形态及聚集状态。
目前,低温透射电镜在生物大分子的成像尤其是蛋白结构的解析方面已经取得了诸多突破的成果,相信在化学分子材料领域也会展现很好的应用前景。
参考文献
[1] Studer, D.; Michel, M.; Wohlwend, M.; Hunziker, E.B. and Buschmann, M.D. J.Microsc. 1995, 179, 321.
[2] Shimoni, E.; Muller, M. J. Microsc. 1998, 192, 236.
[3] Moor, H. Cryothechniques in Biological Electron Microscopy. Berlin: Sringer
-Verlag, 1987.
[4] Moor, H.; Bellin, G.; Sandri, C. and Akert, K. Cell Tissue Res.1980, 209, 201. [5]Moor, H.; Hoechli, M. 1970, 1, 445.
[6] Riehle, U. and Hoechli, M. “Freeze-Etching Technique and Applications” Paris: Soc. Franc. Micros. Elect, 1973.
[7] Kanno, H.; Speedy, R. J. and Angell, C. A. Science, 1975, 189, 880.
[8] Dubochet, J.; Adrian, M.; Chang, J. J.; Homo, J. C.; Lepault, J.; McDowall, A. and Schultz, P. Quart. rev. biophys. 1988, 21, 129.
[9] Sartori, N.; Richter, K. and Dubochet, J. J. Microsc. 1993, 172, 55.
[10] Semmler, K.; Wunderlich, J.; Richter, W. and Meyer, H. W. J. Micros. 1998, 190, 317.
[11] Dimitri, Vanhecke.; Werner, Graber.; Daniel Studer. Methods in cell biology.
